第307号 GMP規格(バリデーション基準)改定と当社業務内容のお知らせ
ご存知のように、バリデーション基準が大きく改定されました
昨年の8月に、GMP実施に関する国際整合性の観点から、PIC/S GMPに合わせて、バリデーション基準が改定発行されました。
□このPIC/Sは、医薬品査察協定及び医薬品査察協同スキームと言われ、
日本も世界の医薬品開発、承認作業、製造進歩に遅れをとらないように
2014年6月に加盟しました。
PIC/S:Pharmaceutical Inspection Convertionand
Pharmaceutical Inspection Co-Operation Schemeの略
□この加盟に合わせたように、
日本のGMPのバリデーション基準は、PIC/S GMPのAnnex15:
Qualification and Validation(適格性評価とバリデーション)と
整合がとられた。
■ こうして、日本のバリデーション基準は大きく内容を
変えることになったと考えられます。
新旧のバリデーション基準で、当社との関わりが深い項目を比較しました
バリデーションの実施項目に注目して、新旧バリデーション基準を対比すると
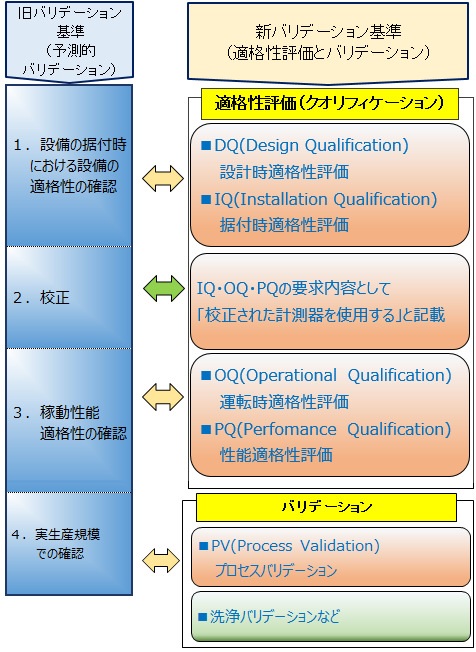
このように、旧バリデーション基準の1,2,3,4が、新バリデーション基準のDQ、IQ、OQ、PQ、PVと名前を変えたとみることができると思います。
即ち、設備、システム又は装置の適格性を評価後、プロセスバリデーションを実施して、それらが製造するために妥当であることを確認することと考えます。
バリデーション支援業務をクオリフィケーション業務と名称変更しました
業務名称を変更した理由は
□ 従来より、新バリデーション基準の適格性評価を専門にお届けしてきた。
□ 規格で定義された言葉を使うことで、お客様などとの共通認識がとり易い。
(言葉だけで、当社の業務内容が理解して頂ける。)
このような考えから、『クオリフィケーション(適格性評価)業務』と
名称変更しました。
クオリフィケーション(適格性評価)のことは、当社にお気軽にお問い合せください。
クオリフィケーション業務の具体的な作業内容は
・バリデーション実施計画書の作成
・現場での妥当性のある検証実務の実施
IQ :設備据付時適格性評価
CAL:キャリブレーション(校正)
OQ:運転時適格性評価
PQ:性能適格性評価
・検証作業結果報告書の作成などになります。
このような適格性評価では、医薬品・医療機器等の製造工場、研究機関のCPC、食品工場等での実績がありますので、当社業務がきっとお役に立てると考えます。
■クオリフィケーション(適格性評価)・校正業務を専門で
やっている企業ならではの視点で、具体的なご提案をしています。
▼ 気になることがありましたら、(以下より)お問い合せ下さい。
https://www.validation-wa-nks.jp/inquiry/
※ 当社は、
フィールドでバリデーションを実施する立場から、規格の要求内容や定義を具現化(具体化)して、お客様に満足して頂ける作業をお届けする努力を続けています。
最後まで、お読みいただき有難うございました。
