第485号 機器導入時、バリデーションのIQ、OQ、PQはどのような考え方で実施したら良いのか(その2)
機器導入時、IQの次に実施するOQはどのように考えたら良い?
ご存じのように、新しい機器を現場に導入するとき、医薬品・医薬部外品GMP省令のバリデーション基準が求める適格性評価では、DQ:設計時適格性評価→IQ:設備据付時適格性評価→OQ:運転時適格性評価を順番に実施することを要求しています。
前回のメルマガでは、IQを進める時の考え方をお届けしましたので、今回は、その次に実施するOQの進め方をご紹介します。
■ IQ同様、規格のOQの定義を読んでも、なかなか具体的な方法が
導き出せないこともあるかと思います。
【GMPバリデーション基準のOQの定義】

皆さんも聞きなれた定義と思いますが、初めて読むと、何をどうしたら良いのと考え込んでしまうのも、頷けるのではないでしょうか
※ OQ(運転時適格性評価)もIQ(設備据付時適格性評価)同様に考えていきます。
OQの定義には、4つのポイントがあります
この4つのポイントを読み解いて、バリデーションのOQとして何をしたらよいか考えていきます。
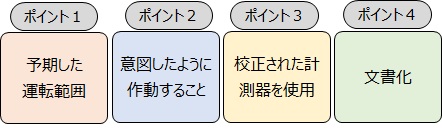
当社独自の4つのポイントの読み解きをご紹介します
ポイント1の読み解きは、「予期した運転範囲」とはどんなドキュメントに記載されているかを考えます。
■ 一般的には、導入する機器の要求を記載した仕様書(要求仕様書)から
展開された設計資料や製造業者の機器の仕様書に記載されていると
考えられます。
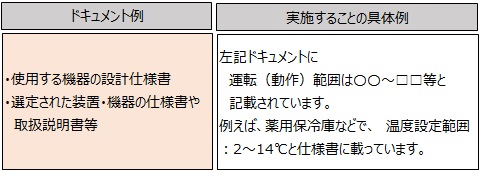
即ち、具体例の場合「予期した運転範囲」は『2~14℃』と考えることができます。
このように、関連するドキュメントに記載されている情報から、OQとして実施する項目や内容がはっきりしてくることになります。
※ 次に、ポイント2を考えてみます。
ポイント2:”意図したように作動すること”を読み解きます
実は、ポイント2の読み解きをすると、OQで実施することはポイント1と同じようなドキュメントに記載されていることが多いと思います。
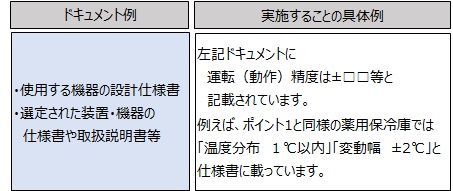
この具体例では、「意図したこと」は、『温度分布1℃以内』『変動幅±2℃』となり、「意図したように作動すること」は、ドキュメントに記載された値になっていることを測定して確認することになります。
※ このように、ポイント1、ポイント2とも、皆さんが良く見られている
資料の中に、進めるための具体的な情報が記載されていることが分かります。
ポイント3:”校正された計測器を使用”を読み解きます
ポイント3の読み解きは、OQ時に登場する計測器に注目する必要があります。

この2種類の計測器を校正すれば良いということになりますが、上段の計測器はIQで校正していますので、OQ時に校正する必要はありません。
■ このように考えると、OQもIQ同様なんだなーと思われる方も多いと思います。
ポイント4:ドキュメントも重要!
”文書化”は、IQ同様、実施計画書と結果報告書などを作成していきます。
当社が提供しています実施計画書の書類名称と目的は、前回のメルマガをご確認ください。
前回のメルマガは、こちらでご覧いただけます。
★https://www.validation-wa-nks.jp/2019/1010_154546.php
次回は、PQを読み解いてご紹介する予定です。
▼▽▼▽ セミナーのご案内▽▼▽▼
当社では、このような規格の定義やその読み解きから、現場で何をどのように実施するのかを具体的にご紹介するセミナーを開催しています。
https://www.validation-wa-nks.jp/seminar/
▼▽▼▽▼▽▼▽▼▽▼▽▼▽▼▽
※ 当社は、フィールドでバリデーション・キャリブレーションを実施する立場から、規格の要求内容や定義を具体化(具現化)して、お客様に満足して頂ける作業をお届けする努力を続けています。
最後まで、お読みいただき有難うございました。
