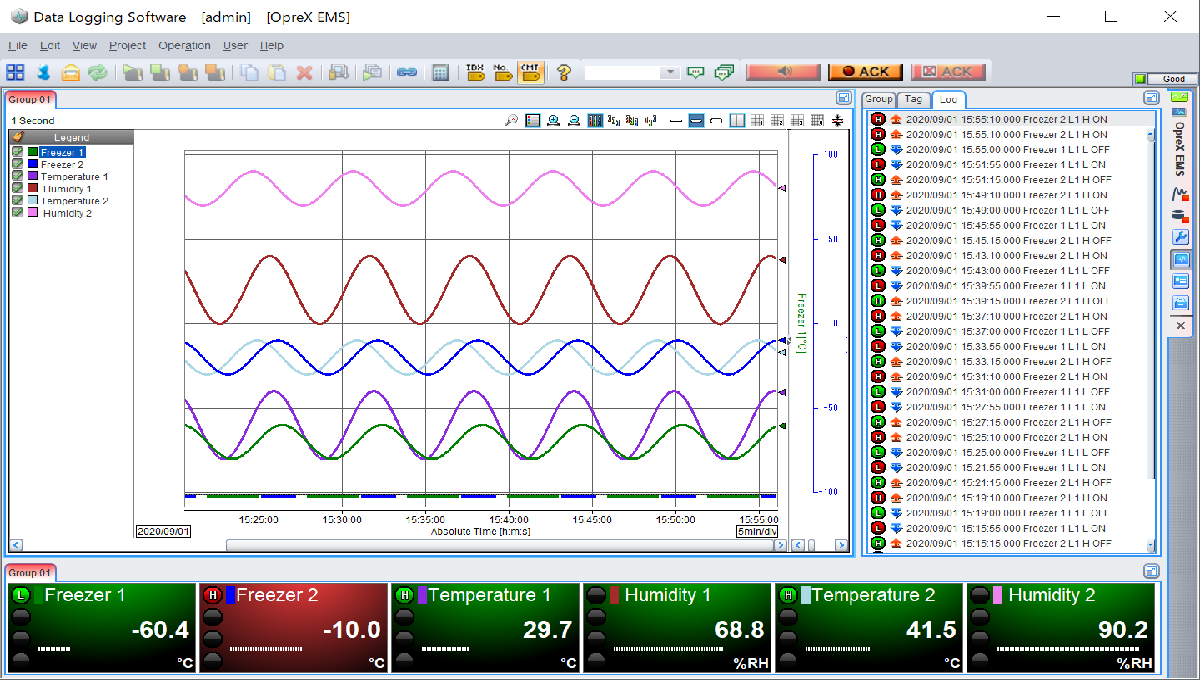
「保管庫」の温度(湿度)モニタリングの測定箇所はどう考える? ~ 第639号 ~
「保管庫」の温度(湿度)モニタリングの測定箇所はどう考える?
> 先日、お客様より製造工場の保管庫の温度(湿度)マッピングを夏・冬に実施しそれぞれの「ホットスポット」と「コールドスポット」は確認できているが、温度(湿度)モニタリングの測定箇所をどのように考えたらよいか?とのご相談をいただきました。
この時期、同様なご相談をいくつかいただきましたので、「悩まれている」または「すっきりしない」
他のお客様がいらっしゃるかもしれません。
■ そんなお客様に向けて、医薬品製造工場、保管庫の「温度(湿度)モニタリング」の測定箇所を考えてみたいと思います。
⇒ いつものように規格要求から確認してみたいと思います。
GMP省令では医薬品の「モニタリング」について書かれていない!
> GMP省令では医薬品の「保管」について「製造工程」と同様にバリデーションにより検証することは書かれていますが、モニタリングについては記載されていません。具体的にどう進めて良いのか悩みどころではないでしょうか。
■ GMP省令
2. バリデーション指針
(1)バリデーションの目的等
バリデーションとは、製造所の構造設備並びに手順、工程その他の製造管理及び品質管理の方法が期待する効果を与えることを検証し、これを文書とすることをいい、(GMP壮麗第2条第13項参照。)、当該校正設備、手順、工程等が適切であり、求められる品質の製品が恒常的に得られる旨を実証することを目的として行うものであること。
(2)バリデーションにより検証する事項
・・・中略・・・
③ 製造工程(保管を含む。)
医薬品及び医薬部外品の製造管理及び品質管理の基準に関する省令の一部改正について(令和3年4月28日)
※ そこで、「保管庫」を対象に製薬工場での温度(湿度)モニタリングの測定箇所設定の進め方を当社なりに考えてみます。
製薬工場での温度(湿度)モニタリングの測定箇所設定の進め方(一例)
> 基本的な進め方は以下の様に「保管庫」という設備のバリデーション(適格性評価)を実施していくことになるのではないでしょうか。
事前準備
「保管庫」への要求項目毎にリスクを想定・検討します。
IOQ
「保管庫」としてリスクの高いエリアを具体的に特定するために温度(湿度)マッピングを実施します。なお、IOQのリスク要因の中で「最も変動が大きい」ことが予想される季節変動(夏/冬)の測定も必要になると思われます。測定結果を踏まえリスクアセスメントを実施しPQへつなげます。
PQ
「製品の保管場所」として温度(湿度)モニタリングの測定箇所を決めるために温度(湿度)マッピングを実施します。測定結果を踏まえリスクアセスメントを実施し測定箇所を検討します。
温度(湿度)モニタリングの測定箇所を決定します。
※ IOQは「保管庫」の評価(無負荷)をし、PQで「製品の保管場所」としての評価(有負荷)をして、「製品の保管場所」としての温度(湿度)モニタリングの測定箇所が決まると考えます。
モニタリングの測定箇所は「最も変動が大きい箇所」を基本として考えます
> 最も変動が大きい箇所を温度(湿度)マッピングで探します。モニタリングの測定箇所はその箇所を基本として考えます。
温度(湿度)マッピングの測定期間中に測定区域内で記録された最高温度値が「ホットスポット」、最低温度値が「コールドスポット」になります。
ただし、夏/冬で「ホットスポット」の箇所と「コールドスポット」の箇所が異なることがあるため、「ホットスポット」と「コールドスポット」には夏/冬それぞれの箇所の網羅が必要と考えています。
また、実際に温度(湿度)マッピングを実施してみると「保冷庫」の「霜取り機能」が作動したなど想定外の事がわかることもあります。
■ 夏の「ホットスポット」の箇所と「コールドスポット」の箇所、冬の「ホットスポット」の箇所と「コールドスポット」の箇所、そして「環境制御の影響(熱源の吹き出し口の近いところ・遠いところ)」や「空気気流の影響(均一化の為の天井ファン、空気気流の出口など)」なども含めて温度(湿度)モニタリングの測定箇所を考えます。
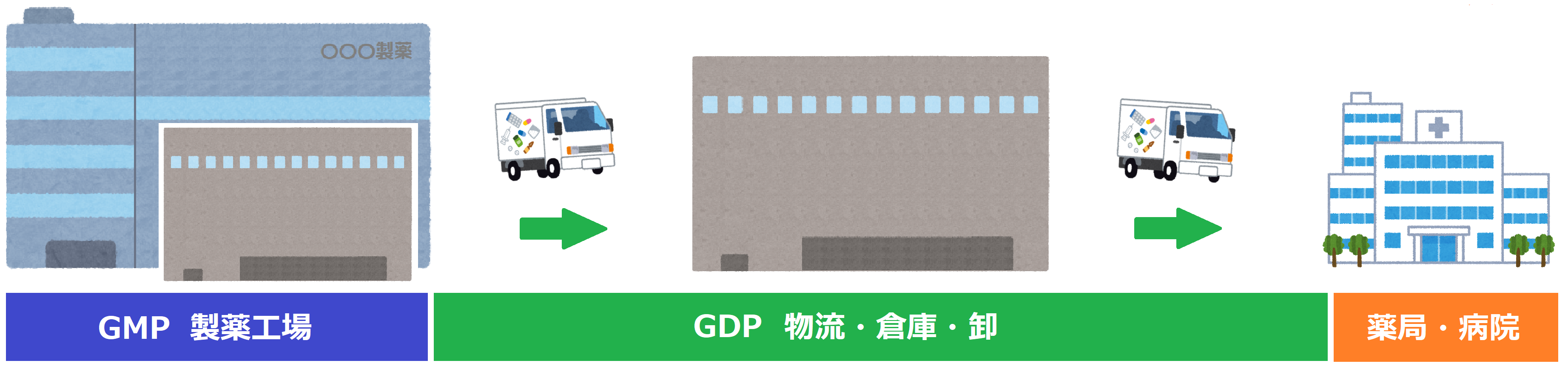
⇒ エヌケイエスでは「GMP 製薬工場」内の「保管」から「GDP 物流・倉庫・卸」における「倉庫保管」を含め、温度(湿度)モニタリング測定箇所設定を目的とした「温度(湿度)マッピング」から「再適格性評価(requalification)」を承ります。
▼ 「温度(湿度)モニタリング」についても「無料オンライン相談会」からご相談していただくこともできます。
※ 当社は、フィールドでバリデーション・キャリブレーションを実施する立場から、規格の要求内容や定義を具体化(具現化)して、お客様に満足して頂ける作業をお届けする努力を続けています。
最後まで、お読みいただき有難うございました。

